|
|
|
|
hvor
|
pi,h
er gassens partialtryk i højden h [Pa] Hi er Henry's konstant for ilt [Pa·l/mg] |
Ifølge fysisk/kemiske love afhænger en gasarts opløselighed, og dermed mætningskoncentrationen i vand, af gassens egenskaber, dens partialtryk over væsken samt væskens temperatur. I dette tilfælde beregnes ilts mætningskoncentration i vand ifølge www.swbic.org.
Henrys lov benyttes til bestemmelse af den opløste gas' molbrøk, xi, ved ligevægt:
|
|
|
|
hvor
|
pi,h
er gassens partialtryk i højden h [Pa] Hi er Henry's konstant for ilt [Pa·l/mg] |
Da barometertrykket falder med højden, skal partialtrykket fundet ved 1 atm.
korrigeres:
|
|
|
| hvor | h er højden over havet [m] |
Henrys konstant for ilt er temperaturafhængig som vist i nedestående tabel:
|
Tabel 6 Henrys konstant. [www.swbic.org] |
|
| Temperatur | Henrys konstant |
| [˚C] | |
| 0 | 2,55 |
| 10 | 3,27 |
| 20 | 4,01 |
| 30 | 4,57 |
| 40 | 5,35 |
| 50 | 5,88 |
| 60 | 6,29 |
En lineær sammenhæng mellem temperaturen og Henrys konstant giver:
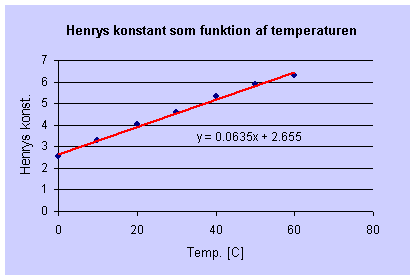 |
| Figur 25 Lineær sammenhæng mellem temperatur og Henrys konstant for ilt. |
Koncentrationen af opløst gas i mol/l findes som:
|
|
|
| hvor | nH2O er molærkoncentrationen af vand=55,56 mol/l |
Omregning fra mol/l til mg/l sker som:
|
|
|